Silimarin/Silibin i kronična bolest jetre: višegodišnji brak
Nealkoholna masna bolest jetre (NAFLD) je potencijalno evolutivna patologija koja uzrokuje nakupljanje masnoće u hepatocitima bez drugih patoloških stanja koja to mogu generirati, kao što su virusni hepatitis, konzumacija alkohola i kronična upotreba droga. Ciroza jetre i HCC predstavljaju zajedničke završne faze različitih hepatopatija.
14. listopad 2022.
Sažetak:
Silimarin je ekstrakt Silybum marianum ili mliječnog čička, a njegova glavna aktivna tvar je silibin koji ima izvanredan biološki učinak. Koristi se kod različitih poremećaja jetre, posebice kroničnih bolesti jetre, ciroze i hepatocelularnog karcinoma, zbog svoje antioksidativne, protuupalne i antifibrotičke moći. Doista, antioksidativni i protuupalni učinak silimarina usmjeren je na smanjenje oštećenja jetre uzrokovanih virusima kroz omekšavanje upalne kaskade i modulaciju imunološkog sustava. Također ima izravan antivirusni učinak povezan s njegovom intravenskom primjenom kod infekcije virusom hepatitisa C. S obzirom na zlouporabu alkohola, silimarin može povećati staničnu vitalnost i smanjiti peroksidaciju lipida i staničnu nekrozu. Nadalje, uporaba silimarina/silibina ima važne biološke učinke kod nealkoholne masne bolesti jetre. Ove tvari antagoniziraju napredovanje nealkoholne masne bolesti jetre intervenirajući u različitim terapijskim ciljevima: oksidativnom stresu, inzulinskoj rezistenciji, nakupljanju masti u jetri i disfunkciji mitohondrija. Silimarin se također koristi kod ciroze jetre i hepatocelularnog karcinoma koji predstavljaju uobičajene završne faze različitih hepatopatija modulirajući različite molekularne obrasce. Stoga je cilj ovog pregleda ispitati znanstvene studije o učincima koji proizlaze iz upotrebe silimarina/silibina u kroničnim bolestima jetre, cirozi i hepatocelularnom karcinomu.
Ključne riječi:
silimarin, silibin, antioksidansi, alkoholna bolest jetre, virusni hepatitis, nealkoholna masna bolest jetre, hepatocelularni karcinom
-
Uvod
Korištenje lijekova dobivenih iz biljnih proizvoda drevna je praksa u znanstvenom istraživanju. Postoji mnogo molekula koje mogu generirati zdrave dobrobiti ako se koriste u širokom rasponu bolesti. Među tim molekulama silimarin je stoljećima imao vrlo važnu ulogu [1]. Uzgoj Silybum marianum kao biljke s potencijalno zdravim učincima datira još iz doba starog Egipta. Doista, dobro je poznato otkriće arheoloških dokaza koji predstavljaju Silybum marianum, koji se nalazi u Egipatskom muzeju. Izvanredna pažnja koju su Egipćani posvetili ovoj biljci vjerojatno je povezana s njezinom vjerojatnom ulogom u ljudskom zdravlju, stoga predstavljena na svakodnevnim predmetima. Još jedna povijesna referenca pronađena je u Bibliji, u kojoj se biljka također naziva “Libanon cardus”. Bolji opis njegovih karakteristika potječe iz doba Plinija Starijeg (23. – 79. po Kr.): njegov sok i sjemenke koristili su se u slučaju trovanja uslijed ugriza zmije i kod melankolične depresije, patologije koja je trebala biti „problem jetre ”. Nakon srednjeg vijeka upotreba šikarice u medicini još se više povećala, a istovremeno su se intenzivirali znanstveni podaci proizašli iz njezine primjene, posebice kod patologija jetre. [2].
Silimarin je ekstrakt biljke Silybum marianum ili čička, a sastoji se od sedam flavonoglignana (silibinin, izosilibinin, silihristin, izosilikristin i silidijanin) i flavonoida (taksifolina) [3]. Među tim tvarima prevladava silibin koji ima najvažniji biološki učinak. Čini oko 70% ukupnog sastava silimarina u obliku dva dijastereoizomerna spoja: silibin A i silibin B [4,5].
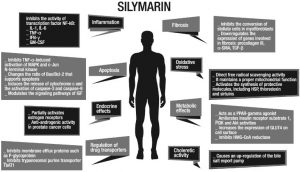
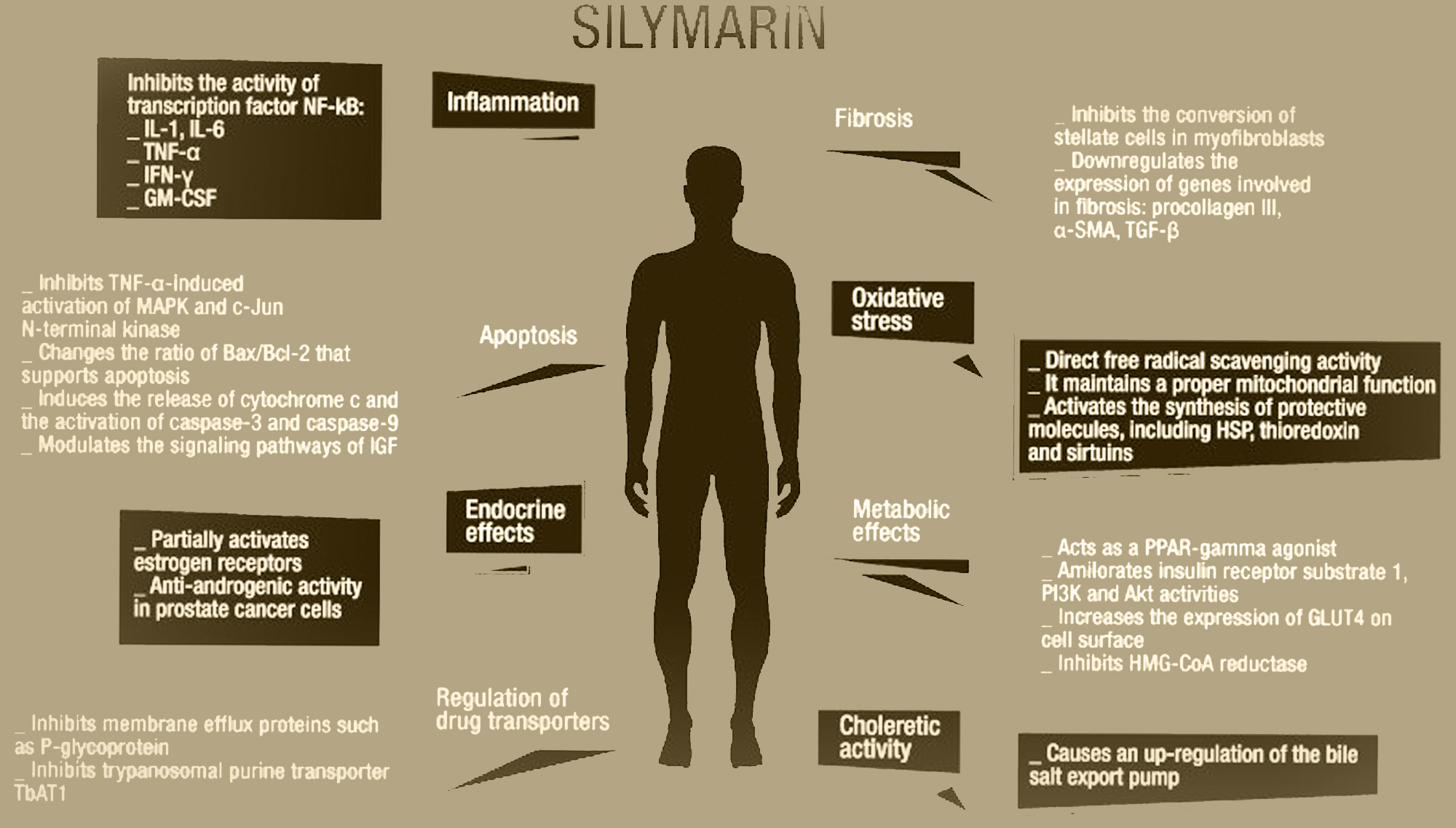
S obzirom na farmakokinetiku, silimarin je spoj niske bioraspoloživosti ako se primjenjuje per os, s nedostatkom topljivosti u vodi. To je zbog njegove neučinkovite apsorpcije u crijevima i povišenog metabolizma prvog prolaza kroz jetru nakon njegove apsorpcije; dva mehanizma koji smanjuju hematsku koncentraciju i posljedično dolazak do ciljnog organa [6,7,8]. Međutim, ovo je ograničenje učinkovito nadmašeno uvođenjem kompleksiranja s fosfatidilkolinom koji ima bolju apsorpciju i novim gliko-konjugatima silibinina (gluko, mano, galakto i lakto-konjugati), koji imaju i visoku topljivost u vodi i jaka antioksidativna moć [9,10]. Povećana apsorpcija ovih spojeva dovela je do procjene sigurnosti silimarina u njegovoj terapijskoj uporabi. Njegova visoka podnošljivost dokazana je studijama toksičnosti na životinjama koje su dugo liječene silimarinom, dok su druge studije na ljudima istaknule, među najčešćim nuspojavama, njegovu dugotrajnu i visoku dozu, glavobolje i svrbež [11,12]. Nisu zabilježeni smrtni slučajevi niti po život opasni nuspojave [12]. Čak i ako je silimarin molekula koja se dobro podnosi, potrebno je istaknuti nekoliko slučajeva znanstvenih dokaza u literaturi koji pokazuju potencijalno štetne učinke: u kliničkom ispitivanju faze I, uporaba 13 g silibina dnevno u bolesnika s rak prostate bio je u korelaciji s hiperbilirubinemijom i povećanjem alanin aminotransferaze (ALT). Štoviše, treba uzeti u obzir moguće nuspojave proizašle iz utjecaja na signaliziranje estrogena, što je potencijalno upotrebljiva funkcija čak i u terapijske svrhe, i na receptor aril ugljikovodika [13,14]. Do sada postignuti znanstveni dokazi omogućuju nam razumijevanje mehanizama djelovanja putem kojih silibin ostvaruje svoju aktivnost u interakciji s različitim tkivima. S tim u vezi, djelovanje silibina očituje se u modulaciji upale i apoptoze, što zajedno s njegovom antioksidativnom snagom predstavlja ključnu točku koja je dovela do njegove primjene u različitim patologijama [15,16,17]. Silibin djeluje putem isključivanja proupalnih signala, proizašlih iz aktivacije nuklearnog faktora-κB (NF-κB), uključenih u indukciju sinteze citokina kao što je faktor nekroze tumora-α (TNF-α), interleukin ( IL)-1, IL-6 i faktor stimulacije kolonija granulocita-makrofaga (GM-CSF) [15,16]. Nadalje, silibin inducira apoptozu modulacijom citoplazmatskih razina bcl-2-sličnog proteina 4 (Bax) i proteina B-staničkog limfoma 2 (Bcl-2), otpuštanjem citokroma c i aktivacijom kaspaze-3 i 9 [17]. Antioksidacijska aktivnost je zbog njegove sposobnosti da djeluje i kao hvatač slobodnih radikala i kao inhibitor peroksidacije lipida, kao što je pokazano in vitro i in vivo [18,19,20,21,22,23,24]. Silimarin je također modulator estrogenske signalizacije [25], inzulinski senzibilizator [24,26,27,28], regulator unutarstaničnog transporta lijekova [29,30,31,32], antikarcinogen [25,33,34,35, 36,37,38,39], antidijabetik kroz regulaciju signala receptora γ aktiviranog proliferatorom peroksisoma (PPAR-γ) [40], antifibrotik [41,42,43,44,45] i koleretik [8] (Slika 1) .
Različita terapeutska djelovanja silimarina. IL-1/6: interleukin 1/6; TNF-α: faktor nekroze tumora-α; IFN-γ: interferon-γ; GM-CSF: faktor stimulacije kolonija granulocita-makrofaga; MAPK: mitogen-aktivirana protein kinaza; Bax: protein 4 sličan bcl-2; Bcl-2: B-stanični limfom 2; IGF: faktor rasta sličan inzulinu; α-SMA: α-aktin glatkih mišića; TGF-β: transformirajući faktor rasta-β; HSP: proteini toplinskog šoka; PPAR-γ: receptor γ aktiviran proliferatorom peroksisoma; PI3K: fosfatidilinozitol-4,5-bisfosfat 3-kinaza; Akt: protein kinaza B; HMG-CoA: 3-hidroksi-3-metilglutaril koenzim A; GLUT 4: transporter glukoze tipa 4. Velik broj djelovanja silimarina objašnjava razlog zašto su provedena mnoga znanstvena istraživanja kako bi se razumjela njegova učinkovitost u različitim patologijama [46]. Kod reumatskih bolesti, kao što je reumatoidni artritis, silimarin djeluje protuupalno tako što inhibira migraciju i aktivaciju neutrofila u zglobovima [47]. Kod različitih onkoloških bolesti, kao što su rak prostate, rak vrata maternice, hepatocelularni karcinom (HCC), rak mokraćnog mjehura i rak pluća, silimarin smanjuje vitalnost stanica i ubrzanu replikaciju stanica [48,49,50,51,52]. Zbog svoje moći detoksikacije, svoje hidrosolubilne endovenske formulacije, koristi se kao anti-hepatotoksični lijek kod trovanja acetaminofenom, arsenom, ugljičnim tetrakloridom, butirofenonima, fenotiazinima i toksinima Amanita phalloides [53,54,55,56]. Kod hiperkolesterolemije, silimarin inhibira 3-hidroksi-3-metilglutaril koenzim A (HMG-CoA) reduktazu, smanjujući sintezu kolesterola [57]. Naposljetku, u neurološkim i psihijatrijskim bolestima ova molekula djeluje putem isključivanja upalnih signala, što je u osnovi degeneracije dopaminergičkih neurona u Parkinsonovoj bolesti, te poboljšava kliničku sliku koja se pripisuje opsesivno-kompulzivnom poremećaju [58,59]. Važno je napomenuti da je uloga biljnih proizvoda u kroničnoj bolesti jetre, koja trenutno predstavlja jedan od najvažnijih zdravstvenih problema u oko 10% svjetske populacije, najviše proučavana tema u znanstvenoj zajednici [60]. Doista, kod kroničnih bolesti jetre, silimarin djeluje kroz različite mehanizme i složene biološke interakcije koje mogu proizvesti dobrobiti u različitim patologijama, od kojih su neke sistemske i mogu zahvatiti jetru. Istraživači su dugo proučavali biološke učinke koje prirodni proizvodi kao što je silimarin imaju na patologije kao što su virusni hepatitis, alkoholna bolest jetre (ALD), metabolički hepatitis, kao i na uobičajene završne faze hepatopatija, to jest ciroze i HCC, na koji silimarin vrši važno biološko djelovanje [46,61]. Cilj ovog pregleda literature je ispitati znanstvene dokaze o učincima koji proizlaze iz upotrebe silimarina/silibina u različitim etiologijama kroničnih bolesti jetre. Spomenuli smo sve radove koji procjenjuju terapijsku ulogu silimarina/silibina u kroničnim bolestima jetre i farmakokinetičke studije od 1980. do 2016. na tim tvarima (jer su studije na ovu temu koje pripadaju navedenom rasponu najzanimljivije u znanstvenoj produkciji i farmakokinetičkim studijama). započeto 1980.), uzimajući u obzir metodologiju korištenu za procjenu cilja, načina primjene i sastava kompleksa silimarin/silibin.
2. Silimarin/Silibin u kroničnoj bolesti jetre2.1.
U današnje vrijeme, iako dolazi do promjene etiologije kroničnih bolesti jetre, različiti sojevi virusnog hepatitisa i dalje predstavljaju važan uzrok kroničnog oštećenja jetre [62]. Antioksidativno i protuupalno djelovanje silimarina omogućuje nam da lako razumijemo njegovu potencijalno zdravu aktivnost usmjerenu na smanjenje oštećenja jetre uzrokovanog virusom kroz ublažavanje upalne kaskade i modulaciju imunološkog sustava [63]. Međutim, odnos između kroničnog virusnog hepatitisa i silimarina ne može se ograničiti na ovu jednostavnu aproksimaciju. Iz analize literature moguće je zaključiti o lošoj kvaliteti i nedostatku studija koje analiziraju interakciju silimarina i infekcije virusom hepatitisa B (HBV). Meta-analiza koju su proveli Wei et al. procijenili su učinkovitost i sigurnost silimarina i njegove terapijske kombinacije s antivirusnim lijekovima (lamivudin i interferon) u liječenju HBV kroničnog hepatitisa [64]. Istraživanje je istaknulo da je iz analiziranih studija moguće zaključiti sličnu učinkovitost silimarina i antivirusnih sredstava u normalizaciji razina aspartat aminotransferaze (AST) i ALT, kao i ekvivalentnu negativnu stopu konverzije serumskog HBsAg (relativni rizik (RR). ) = 1,50; 95% interval pouzdanosti (CI) = 0,18–12,35) i HBeAg (RR = 1,80; 95% CI = 0,43–7,60). Nadalje, istaknuli su da je silimarin, povezan s upotrebom antivirusnih lijekova, mogao potaknuti veliki učinak na smanjenje razine transaminaza u serumu u usporedbi s upotrebom samih antivirusnih lijekova [64]. Usprkos tome, isti su autori izjavili da nema značajnih podataka u literaturi koji bi sugerirali upotrebu silimarina u kombinaciji s antivirusnom terapijom u liječenju kronične HBV infekcije, vjerojatno zbog raznih kritika u konstrukciji analiziranih ispitivanja [64]. Slične rezultate dobili su i drugi istraživači, koji su istaknuli ulogu silimarina u induciranju smanjenja razine transaminaza tijekom virusnog hepatitisa. Međutim, s obzirom na histologiju ili sadržaj virusa u serumu, nije bilo izravnih učinaka zbog njegove uporabe [47].
Virus C kroničnog hepatitisa (HCV) predstavlja najčešći uzrok virusne kronične hepatopatije u svijetu, osobito nakon uvođenja HBV cijepljenja 1980-ih [65]. Iako u kliničkoj praksi većina pacijenata zaraženih HCV-om, koji su podvrgnuti ili nisu podvrgnuti antivirusnom liječenju, koriste biljne proizvode kao što je silimarin, njegova se primjena ne može preporučiti jer nije potkrijepljena značajnim znanstvenim dokazima [66]. Kao što je istaknuto analizom znanstvene literature, čak i za ulogu silimarina u određivanju blokade ulaska i fuzije HCV-a i replikacije virusa [67,68,69,70,71,72], u meta-analizi Yanga i sur. ., dokazan je zdrav učinak na razinu HCV-RNA u serumu (iako nije statistički značajan). Ovaj učinak je dokazan samo kada je silimarin primijenjen i per os i putem intravenske injekcije visoke doze [66]. Intravenska primjena silibina može inhibirati replikaciju virusa izravnim utjecajem na životni ciklus HCV-a. Doista, sposoban je inhibirati funkciju RNA polimeraze ovisne o HCV RNA neovisno o antivirusnim putovima izazvanim intracelularnim interferonom (IFN) [71]. Silimarin ne može blokirati vezanje HCV-a na stanice; međutim, blokira i ulazak HCV-a i fuziju HCV-a s liposomima [69]. Nadalje, silimarin, ali ne i silibin, inhibira aktivnost RNA polimeraze ovisne o JFH-1 genotipu 2a NS5B, aktivnost proteina prijenosa mikrosomalnih triglicerida, izlučivanje apolipoproteina B i, prema tome, istjecanje infektivnog viriona iz stanice [69]. Učinke na inhibiciju replikacije virusa provedenu intravenskom primjenom također su analizirali Ferenci i sur., koji su pokazali kako silibin, blokiranjem funkcije HCV polimeraze pri polumaksimalnoj inhibicijskoj koncentraciji (IC50) između 75 µM i 100 µM, može smanjiti virusno opterećenje HCV-a s tri na četiri loga unutar jednog/četiri tjedna kod prethodnih pacijenata koji nisu odgovorili na peginterferon [73]. Ova činjenica je potvrđena prikazom slučaja u kojem je naglašen potencijalni izravni antivirusni učinak proveden kombiniranim liječenjem od 238 dana s 1200 mg/dan endovenskog silimarina, 1200 mg/dan ribavirina i 6000 U/dan vitamina D. . Pokazalo se da je ovaj terapijski pristup vrlo podnošljiv i omogućio je postizanje održivog virološkog odgovora (SVR) kod 44-godišnje pacijentice zaražene HCV genotipom 1 s prethodnim neuspjehom terapije na temelju interferona i ribavirina [74]. Štoviše, endovenska primjena silimarina može smanjiti virusno opterećenje pacijenata zahvaćenih genotipom 3 HCV-a, otvarajući vrata mogućoj terapijskoj kombinaciji s najnovijim terapijama izravnog djelovanja antivirusnih lijekova (DAA), u svjetlu najnovijeg iskorjenjivanja virusa podaci za različite HCV genotipove, prema genotipovima koje je teško liječiti [75,76,77]. Prije nekoliko godina, prije novih terapija temeljenih na DAA, endovenozno liječenje silimarinom također je proučavano kao moguća adjuvantna, uvodna terapija tijekom 14 dana (20 mg/kg/dan) praćena trostrukom terapijom peginterferonom-ribavirinom i telaprevirom za 12 tjedana, kako bi se postigao SVR kod pacijenata koje je teško liječiti: pacijenata koinficiranih HCV-om/virusom humane imunodeficijencije (HIV) ili s uznapredovalom fibrozom, kod kojih je utvrđena stopa iskorjenjivanja virusa od 63%, što je više od dobivenih podaci, za istu vrstu pacijenata, iz CUPIC-a (suosjećajna upotreba inhibitora proteaze kod virusne C ciroze) i REALIZE (Studija sigurnosti i učinkovitosti telaprevira kod pacijenata s kroničnim, genotipom 1, hepatitisom C koji nisu uspjeli prethodno standardno liječenje) (20% i 50%, respektivno) studije [78,79,80]. Ovi zanimljivi podaci moraju se ponovno procijeniti u svjetlu najnovijih terapija za iskorjenjivanje HCV infekcije, u kojima većina DDA terapijskih režima postiže stope SVR-a veće od 90% i pojavu nuspojava manje od prethodnih terapija koje se temelje na interferonu i ribavirin. Shodno tome, u kliničkoj praksi nije primjenjiva svakodnevna endovenozna terapija bazirana na silimarinu.
2.3. Nealkoholna masna bolest jetre
Nealkoholna masna bolest jetre (NAFLD) je potencijalno evolutivna patologija koja uzrokuje nakupljanje masnoće u hepatocitima bez drugih patoloških stanja koja to mogu generirati, kao što su virusni hepatitis, konzumacija alkohola i kronična upotreba droga [92]. S obzirom na epidemiologiju, u posljednjih nekoliko godina incidencija NAFLD-a pokazuje eksponencijalni porast u zapadnim zemljama; naprotiv, dokazano je smanjenje virusnog hepatitisa. Stoga će NAFLD biti najčešći uzrok kronične hepatopatije u bliskoj budućnosti [92]. Danas je NAFLD drugi najčešći uzrok razvoja HCC-a i druga najčešća indikacija za transplantaciju jetre [93,94,95,96]. Patogeneza NAFLD-a uključuje i genetske čimbenike i čimbenike okoliša, koji potiču pojavu inzulinske rezistencije, koja igra ključnu ulogu u metaboličkom sindromu, složenom sustavnom stanju [97,98,99,100,101,102,103,104]. Trenutačno se problem s kojim se treba pozabaviti tiče nedostatka specifičnih terapijskih pristupa koji bi mogli antagonizirati progresiju u teške oblike ili intervenirati razbijanjem složene mreže patogenetskih događaja koji uzrokuju njegovu pojavu [105,106]. Ovaj problem još je relevantniji ako uzmemo u obzir povećanu distribuciju NAFLD-a u pedijatrijskoj populaciji, u kojoj produljeni životni vijek može dovesti do progresije patologije od “jednostavnog” nakupljanja masti u jetri do upale, ciroze i HCC-a, što se manifestira u mladosti u usporedbi s HCC-om uočenim kod virusnog hepatitisa [107,108]. Znanstveni dokazi učinkovito prikupljeni u najnovijim Smjernicama kliničke prakse Europske udruge za proučavanje jetre (EASL) – Europske udruge za proučavanje dijabetesa (EASD) – Europske udruge za proučavanje pretilosti (EASO), naglašavaju poboljšanje histološku sliku i serumske jetrene enzime dobivene gubitkom težine od oko 7%–10% (razina dokaza B1). Gubitak tjelesne težine postiže se kako zdravom prehranom, točnije mediteranskom prehranom bez konzumacije prerađene hrane, bez hrane i pića s visokim udjelom fruktoze, tako i regulacijom sastava makronutrijenata (razina dokaza B1), uz aerobne vježbe i vježbe otpora ( B2 razina dokaza) [109,110]. Nadalje, analiza potencijalno upotrebljivih farmakoloških pristupa trenutno je izazvala kontroverze i sumnje o stvarnom učinku na zdravlje jetre, kao io podnošljivosti zbog dugotrajne uporabe [109]. U tom kontekstu, različite studije pokušale su povezati upotrebu silimarina/silibina s biološkim učincima koji mogu antagonizirati napredovanje NAFLD-a, intervenirajući na različite terapijske ciljeve (Slika 2).
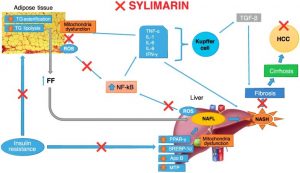
Slika 2
Terapeutski ciljevi silimarina u nealkoholnoj masnoj bolesti jetre. TG: trigliceridi; ROS: Reaktivne vrste kisika; IL-1/6/8: interleukin-1/6/8; TNF-α: faktor nekroze tumora alfa; INF-γ: interferon-gama; TGF-β: transformirajući faktor rasta-beta; NF-κB: nuklearni faktor kappaB; FF: slobodna mast; NAFL: nealkoholna masna jetra; NASH: nealkoholni steatohepatitis; HCC: hepatocelularni karcinom; PPAR-γ: receptor gama aktiviran proliferatorom peroksisoma; SREBP: proteini koji vežu regulatorne elemente sterola; Apo B: apolipoprotein B; MTP: mikrosomalni prijenosni protein triglicerida. Silibin bi mogao biti inzulinski senzibilizator: sposoban je smanjiti intrahepatično nakupljanje masti, lobularnu upalu, baloniranje i serumsku masnoću, kao i poboljšati procjenu modela homeostaze-IR indeks (HOMA-IR) i test tolerancije na inzulin (ITT) [26] . Štoviše, silibin ima važnu ulogu u smanjenju nakupljanja visceralne masti, u induciranju lipolize putem transkripcije gena za adipoznu triglicerid lipazu (ATGL) i inhibiciji glukoneogeneze za utišavanje nekih gena uključenih u gore spomenuti metabolički put [26]. Unatoč tome, u ovom radu nije jasno vrijeme primjene čistog silibina, odnosno bez molekula koje povećavaju njegovu oralnu bioraspoloživost, i dijete bogate mastima (HFD) u skupini štakora hranjenih HFD+silibinom. Stoga, uzimajući u obzir nisku bioraspoloživost čistog silibina, ako se primjenjuje per os [111], ne može se isključiti da bi ishod opažen u ovoj studiji mogao ovisiti o smanjenju apsorpcije masti sadržane u HFD-u posredovanom stvaranjem neapsorpcijskih kompleksa sa silibinom, a ne ovisno o njegovoj stvarnoj ulozi u prekidanju patogenetskih mehanizama koji su odgovorni za NAFLD. Učinak inzulina u određivanju njegovih bioloških učinaka povezan je s aktivacijom supstrata 1 receptora inzulina (IRS-1)-fosfatidilinozitol-3-kinaze (PI3K)-protein kinaze B (Akt) koji može generirati aktivaciju supstrata kao što su Akt supstrat 160 i posljedično ekspresija transportera glukoze tipa 4 (GLUT4) na površini stanice [112]. Povećanje fosforilacije u IRS-1 i PI3K serinu, kao što se događa kod inzulinske rezistencije, posredovano je aktivacijom c-Jun N-terminalne kinaze (JNK) i nuklearnog faktora-κB kinaze β (IKK-β), kao što se događa u eksperimentalni modeli inzulinske rezistencije inducirane HFD-om ili palmitinskom kiselinom [27,113,114]. Tretman s rastućim dozama silibina (16, 40 i 100 μg/mL), in vitro, može generirati povećanje kaptaže glukoze, potaknuto inzulinom u modelu inzulinske rezistencije izazvane palmitatom na stanicama mioblasta C2C12, u pri čemu je uloga silibina ključna u povećanju aktivnosti PI3K [27]. U preliminarnoj opservacijskoj studiji naše skupine 2006. istaknuli smo kako liječenje kompleksom silibin-vitamin E-fosfolipidi (376 mg silibina, 776 mg fosfatidilkolina i 360 mg vitamina E/dan) tijekom šest mjeseci može poboljšati ultrasonografiju svijetle jetre, razine jetrenih enzima, HOMA-IR i serumske indekse fibroze jetre [28]. Povezanost silibina s fosfatidilkolinom stvara silibin-fitosom koji je sposoban lako nadmašiti stijenku crijeva i doći do jetre u povećanim količinama. Međutim, uporaba kompleksa silibin-vitamin E-fosfolipidi ne proizvodi učinke na brzinu metabolizma prvog prolaska silibina kroz jetru. Vitamin E se ne koristi u antioksidativne svrhe, s obzirom na njegovu nisku dozu, ali je kemijski stabilizator za fitosome. Ovaj preliminarni rezultat potvrđen je u multicentričnom, dvostruko slijepom kliničkom ispitivanju faze III na 180 pacijenata s histološkom dijagnozom NAFLD/nealkoholnog steatohepatitisa (NASH), s nekoliko HCV pozitivnih pacijenata (36 pacijenata). Analizirani su podaci 138 pacijenata, pokazujući da je primjena kompleksa silibin-vitamin E-fosfolipidi (188 mg silibina, 388 mg fosfatidilkolina i 180 mg vitamina E/dan) tijekom 12 mjeseci normalizirala razine transaminaza i poboljšala Razine γ-GT i stupanj steatoze na ultrazvuku, iako na statistički značajan način. Nadalje, liječenje je povezano s poboljšanjem glikemije bez hrane, inzulinemije i HOMA-IR. U 35 pacijenata liječenih kompleksom silibin-vitamin E-fosfolipidi, pokazano je jasno poboljšanje steatoze, lobularne upale, baloniranja i fibroze jetre, u usporedbi s početnom vrijednošću, provođenjem druge biopsije jetre na kraju dvanaestog mjeseca [ 115].
Bolesnici s NASH-om i naizgled sličnim kliničkim/biokemijskim karakteristikama mogli bi se razlikovati u odgovoru na moguću terapiju kompleksom silibin-vitamin E-fosfolipidi u odnosu na razinu markera peroksidacije lipida u serumu (TBARS) i rezultat aktivnosti NAFLD na početku. Na taj je način moguće identificirati bolesnike s većom vjerojatnošću da dobiju korist od liječenja, što je također istaknuto analizom lipidomskog profila seruma [116]. Metabolička aktivnost silimarina također se očituje kroz modificiranje gena uključenih u metabolizam lipida, kao i u kontrolu oksidativnog stresa. Korištenje silimarina tijekom četiri tjedna kod miševa s pretilošću uzrokovanom prehranom pokazalo je jasno poboljšanje razine triglicerida (TG) u plazmi; lipoproteina niske gustoće (LDL) i lipoproteina visoke gustoće (HDL), kao i poboljšanje intrahepatičnog nakupljanja lipida i NAS skora [117]. Ovi se rezultati ne mogu pripisati niti smanjenom dnevnom unosu kalorija niti gubitku tjelesne težine, koji se potencijalno može postići tijekom liječenja. Stoga se djelovanje silimarina u NAFLD-u jasno očituje kroz njegovo djelovanje na različite terapijske mete uključene u patogenetski proces koji dovodi do njegovog nastanka i pogoršanja. U tom smislu, silimarin je vjerojatno jedna od najperspektivnijih molekula, upotrebljiva u terapiji NAFLD-a, koja djeluje na višestruke terapijske ciljeve i ima visok sigurnosni profil, s obzirom na nužnost dugotrajnog liječenja. Međutim, upotreba silimarina u svakodnevnoj kliničkoj praksi mogla bi imati koristi od znanstvenih dokaza stečenih ispitivanjima koja se temelje na populaciji pacijenata s NAFLD-om i pedijatrijskih bolesnika.
2.4. Ciroza i hepatocelularni karcinom
Ciroza jetre i HCC predstavljaju zajedničke završne faze različitih hepatopatija. Prvo, upala igra važnu ulogu u izazivanju i pogoršanju fibroze. Aktivacija transkripcijskih čimbenika, kao što je NF-κB, a potom i sinteza proupalnih citokina, stanje koje je u osnovi svih vrsta kroničnih oštećenja jetre, izaziva povećanje transkripcije gena uključenih u taloženje proteina izvanstaničnog matriksa iz zvjezdastih stanica i TGF-β iz Kupfferovih stanica. Ovo taloženje, zajedno s povećanom sintezom tkivnog inhibitora metaloproteinaza (TIMPs), ruši strukturu i funkciju jetre, dovodeći do patološke slike ciroze [118]. Čak bi i inzulinska rezistencija, tipična za NAFLD, mogla imati potencijalni profibrotični učinak. Doista, aktivacija JNK, vrlo često stanje kod inzulinske rezistencije, može potaknuti izlučivanje upalnih citokina i aktivaciju zvjezdastih jetrenih stanica [113,114,119]. Silimarin učinkovito ometa fibrogenetski proces: njegova primjena tijekom četiri tjedna, u Wistar štakorima, u dozama koje se uobičajeno koriste u terapijske svrhe kod hipertransaminemije u svakodnevnoj kliničkoj praksi (50 mg/kg za miševe) mogla bi, u modelu CCl4 induciranog fibroza jetre, za smanjenje oštećenja hepatocita, markeri oksidativnog stresa, rezultat fibroze i tkivna hijaluronska kiselina te aktivacija HSC i Kupfferovih stanica [120]. Glavni razlog vezan uz navedeno zapažanje treba tražiti u citoprotektivnom učinku, kao i onom antioksidativnom, koji ostvaruje silimarin. Doista, smanjenje stanične nekroze, obično povezane s kroničnim upalnim stanjima, uzrokuje manje oslobađanje čimbenika koji mogu aktivirati HSC, uključujući TGF-β, TNF-α, IL-1, IL-6, ROS, itd., i prekida začarani krug koji povećava samu upalu. Presudnu ulogu u progresiji oštećenja jetre do razvoja fibroze i ciroze ima čimbenik aktivacije trombocita (PAF), čija proizvodnja, usko povezana s koegzistencijom upale tkiva, omogućuje HSC-u da proizvede veliku količinu kolagena. 121,122,123,124]. Kapacitetu remodeliranja pripisanom PAF-u suprotstavio bi se proces acetilacije podržan enzimima lizofosfatidilkolin aciltransferaze (LPCAT), čija je ekspresija jasno niža u bolesnika s cirozom u usporedbi s kontrolnom skupinom. U tom pogledu, silibin može antagonizirati profibrotski učinak koji provodi PAF povećanjem ekspresije LPCAT, kao i izravnim smanjenjem PAF-a u cirotičnih Wistar štakora [125]. Promjena metabolizma lipida zbog mitohondrija u uvjetima mitohondrijske disfunkcije mogla bi predstavljati jedan od mehanizama koji omogućuje progresiju različitih vrsta kroničnih oštećenja jetre, kao što su NAFLD i sekundarna bilijarna ciroza [126,127]. Sama mitohondrijska disfunkcija, povezana s nekim patologijama jetre, može inducirati povećanje proizvodnje ROS-a, što dovodi do pogoršanja oštećenja stanica. U tom pogledu, silibin potiče mitohondrijsko funkcioniranje cirotičnih jetara induciranjem poboljšanja transporta mitohondrijskog citrata i, posljedično, promicanjem eliminacije ROS-a i učinkovitosti transportnog lanca mitohondrija [128]. U našoj in vivo studiji, liječenje kompleksom silibin-vitamin E-fosfolipidi tijekom 12 tjedana uspjelo je smanjiti fibrozu jetre u 35 pacijenata koji su bili podvrgnuti biopsiji jetre na početku, i na kraju liječenja, generirajući podatke koji još nisu znanstveno su ocijenili u literaturi druge istraživačke skupine [115]. Učinak silimarina u antagoniziranju taloženja fibrotičnog tkiva mora se uzeti u obzir isključivo s obzirom na de novo fibrogenezu u stanjima kroničnog oštećenja jetre. Uznapredovala fibroza je ireverzibilno stanje. Posljedično, nije ga moguće liječiti lijekovima [129]. Kod ovih tipova pacijenata, korištenje silimarina ne proizvodi nikakve zdravstvene učinke. Stoga bi primjena silimarina za antifibrotičke učinke kod kroničnih hepatopatija mogla poboljšati kliničku sliku samo ako se provodi u ranoj fazi patologije. Ciroza jetre, neovisno o etiologiji kroničnog oštećenja jetre, faktor je rizika za razvoj HCC-a. Učestalost HCC-a posljednjih se godina povećala u razvijenim zemljama svijeta, postavši drugi uzrok smrti od neoplastičnih bolesti u svijetu, budući da je odgovoran za oko 750 000 smrtnih slučajeva godišnje [130]. Farmakološki pristup HCC-u trenutno predstavlja terapija sorafenibom, inhibitorom receptorske tirozin kinaze, koji se koristi u uznapredovalim i metastatskim oblicima patologije. Produženi životni vijek dobiven ovom terapijom varira ovisno o analiziranim podacima i statusu pacijenta, ali smanjuje kvalitetu života zbog nuspojava povezanih s terapijom [131].
U štakorskom modelu HCC-a izazvanom N-nitrozodietilaminom (NDEA), Gopalakrishnan et al. pokazalo je da je liječenje silimarinom moglo učinkovito modulirati različite molekularne obrasce u antikarcinogenom smislu [132]. Poliklonsko protutijelo zečjeg antiproliferirajućeg nuklearnog antigena (PCNA) u razrjeđenju od 1:50 marker je staničnog ciklusa: njegova povećana ekspresija obično se povezuje s hiperproliferacijom stanica [133]; slično, razine argirofilne nukleolarne organizatorske regije (AgNOR) izravno su povezane s prijelazom iz G1 u S fazu staničnog ciklusa [134]. Silimarin može smanjiti ne samo razine PCNA i AgNOR u usporedbi s kontrolama, već i sadržaj glikoproteina/glikokonjugata u serumu i jetri, koji bi mogao biti povećan u mnogim neoplastičnim bolestima [132,135,136,137,138]. Silimarin također smanjuje razine β-katenina, koji, krećući se u jezgru, potiče ekspresiju pro-proliferativnih gena [139], kako bi se smanjio omjer Bcl2/Bax, potičući apoptozu, i smanjuje potencijal mitohondrijske membrane vjerojatno povezan s otpuštanjem citokroma c u citoplazmi [132]. Lah i sur. dokazao da silibin značajno smanjuje rast HuH7, HepG2, Hep3B i PLC/PRF/5 stanica ljudskog hepatoma povećanjem kompleksa inhibitora ciklin-ovisne kinaze p21 i p27/ciklin-ovisne kinaze (CDK) 4, smanjenjem proteina retinoblastoma (Rb)- fosforilacijski i transkripcijski faktor E2F1/transkripcijski faktor dimerizacije Partner (DP) 1 kompleks, kao i promicanjem indukcije kodificirajućih gena za kaspazu 3-9 i smanjenjem razine survivina, čija je sovraekspresija povezana sa smanjenjem stanične smrti [140,141] . Štoviše, antineoplastični učinak silibina mogao bi se povezati s povećanom aktivnošću homologa fosfataze i tenzina izbrisanih na desetom kromosomu (PTEN) i smanjenom produkcijom p-Akt s modulacijom signalizacije proteinskih kinaza 1 i 2 (ERK1/2) reguliranih izvanstaničnim signalom. ), i konačno, s antiangiogenetskim učinkom, što je istaknuto smanjenjem ekspresije klastera diferencijacije (CD)-34 i matrične metaloproteinaze (MMP)-2, koji predstavljaju markere angiogeneze i metastatske invazije [ 141,142,143,144]. Analiza literature pokazuje veliku količinu pretkliničkih in vitro i in vivo studija, koje učinkovito dokazuju potencijalnu molekularnu metu na koju silibin djeluje u antikarcinogene svrhe. Doista, silibin bi mogao interferirati s procesom indukcije tumora, kroz regulaciju upalne kaskade i smanjenjem genotoksičnog potencijala ROS-a. Štoviše, također bi mogao ometati napredovanje tumora blokiranjem većine signalnih putova aktiviranih u HCC-u. Konačno, silibin može poboljšati kvalitetu života pacijenata koji su bili podvrgnuti konvencionalnom liječenju sorafenibom u uznapredovalim oblicima HCC-a. Unatoč tome, postoji veliko ograničenje u pogledu njegove velike terapijske upotrebe koje proizlazi iz nedostatka podataka dobivenih u ispitivanjima na velikoj populaciji pacijenata i poteškoća u usklađivanju životinjskog modela, korištenog u većini studija, s ljudskim. .
-
Zaključci
“Mnogogodišnji brak” koji povezuje silimarin/silybin s bolestima jetre, proizlazi iz progresivnih dokaza koji su, s vremenom, doveli do istraživanja, prvo empirijski, a zatim i znanstveno, mehanizama putem kojih oni djeluju u provođenju terapijski učinak. Studije farmakokinetike i farmakodinamike silimarina u posljednjih su nekoliko godina poboljšale njegovu primjenjivost u različitim patologijama, posebice bolestima jetre, omogućujući, korištenjem konjugata spojeva, učinkovitiju primjenu. Analizom literature dokazano je da silimarin ima djelovanje koje omogućuje njegovu primjenu kod svih najčešćih uzroka oštećenja jetre. Doista, silimarin ima tri važne aktivnosti: protuupalnu, antioksidativnu i pro-apoptotičku, koje predstavljaju “funkcionalnu trijadu” koja omogućuje antagoniziranje nastanka i napredovanja mehanizama oštećenja koji su odgovorni za progresiju hepatitisa u cirozu i HCC. . Međutim, jasno je da, također u završnim fazama jetrenih patologija, silimarin može djelovati ograničavajući de-novo fibrogenezu i antagonizirajući prokarcinogene mehanizme koji uzrokuju HCC. Usprkos tome, liječenje silimarinom/silibinom u rutinskoj kliničkoj praksi je jako ograničeno, jer je potrebno prikupiti znanstvene podatke koji proizlaze iz dobro strukturiranih ispitivanja na velikim populacijama pacijenata i postići standardizaciju metoda koje se koriste za procjenu terapijske učinkovitosti. , posebno u kontekstu NAFLD-a, to je posebno obećavajuće.Go to:
Priznanja
Zahvaljujemo Maddaleni Farina (drugi ciklus studija lingvistike i prevođenja za posebne namjene) na njezinoj pomoći na engleskom jeziku i anthosagency.it za grafiku.Go to:
Sukob interesa
Autori izjavljuju da nema sukoba interesa.
Reference
*![]()